▌论文标题:
Structural Basis for RNA Replication by the SARS-CoV-2 Polymerase ▌论文网址: https://www.cell.com/cell/fulltext/S0092-8674(20)30629-2 ▌DOI: https://doi.org/10.1016/j.cell.2020.05.034
2020年1月31日,Cell Press新型冠状病毒资源中心正式开放。您可以在该资源中心页面上查找到COVID-19相关论文的投稿政策,以及Cell Press旗下期刊已发表的有关疫情和病毒的论文。网站正在不断更新中,所有内容都可以免费阅读,点击查看。
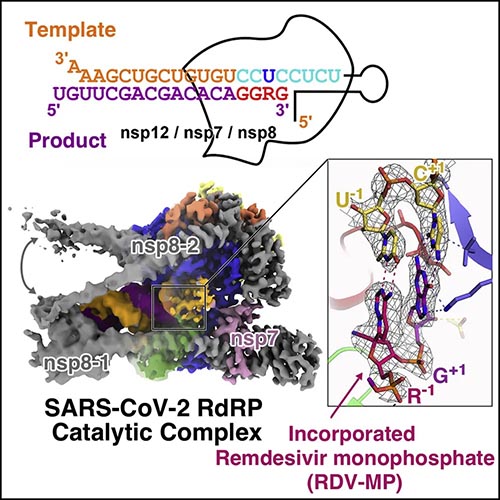
最新在中心上线的发表在Cell Press细胞出版社旗下期刊Cell上的研究,名为”Structural Basis for RNA Replication by the SARS- CoV-2 Polymerase”, 该研究出自清华大学饶子和院士、娄智勇教授团队,阐明了新冠病毒生命周期中核心的超分子蛋白质机器“转录复制复合体”的“帽结构合成中间状态”与“核酸合成延伸状态”两个过程的分子机制,揭示新的抗病毒药物作用靶点。
Cell Press细胞出版社微信公众号对该论文进行了解读,旨在与广大科研人员深入分享该文以及一些未来的展望,点击“阅读原文”或识别下图二维码阅读英文原文。
新冠病毒SARS-CoV-2引发的COVID-19疫情至今已造成全球4700多万人感染和120余万人死亡。在病毒侵入宿主细胞后,所编码的一系列非结构蛋白要形成复杂的超分子蛋白质机器“转录复制复合体”(RTC),包含了聚合酶、引物酶、解旋酶、甲基转移酶、核酸酶以及多种辅因子蛋白,负责病毒转录复制的核心过程,涵盖了众多抗病毒药物设计的关键靶点。新冠疫情发生后,饶子和院士团队针对抗病毒关键靶点,迅速开展科研攻关。先后阐明了两个最关键药物靶点蛋白的结构信息,即主蛋白酶Mpro,以及由聚合酶nsp12、引物酶nsp8和辅因子nsp7组成的“核心转录复制复合体”(C-RTC),以及C-RTC与核酸和瑞德西韦复合物的三维结构,为认识病毒的生命过程、发展高效抗病毒药物提供了关键信息。 论文摘要 核苷酸类似物抑制剂,包括广谱瑞德西韦(remdesivir)和法匹拉韦(favipiravir),已经在体外检测和一些临床研究中显示出治疗COVID-19的前景,尽管对病毒RNA依赖的RNA聚合酶nsp12的药物相互作用还没有得到完全的理解。在这里,我们通过测定停滞的前易位-后易位聚合酶复合物的冷冻电镜结构来研究SARS-CoV-2 RNA复制的分子基础。与apo复合物相比,nsp12及其辅助因子nsp7和nsp8发生了显著的结构重排以适应核酸,而nsp12中有高度保守的残基,定位了模板和引物,可对进入的核苷酸进行顺列攻击。此外,我们还通过结构和动力学分析,探讨了瑞德西韦三磷酸代谢物的抑制机制。本文还提出了一个从nsp7-nsp8十六聚引酶复合物到nsp12-nsp7-nsp8聚合酶复合物的转化模型,为了解冠状病毒的转录和复制机制提供了线索。 研究亮点 研究团队针对新冠病毒mRNA的形成机制进行探索。新冠病毒的mRNA需要一个独特的“帽结构”(cap),帮助完成病毒蛋白质翻译、逃逸宿主先天免疫等生理过程。帽结构加工分为四步,即(1)由pppA-RNA生成ppA-RNA [cap(-2)]、(2)合成GpppA-RNA [cap(-1)]、(3)合成7MeGpppA-RNA [cap(0)]和(4)合成7MeGpppA2’OMe-RNA [cap(1)]。研究团队首先成功组装成第二步向第三步过渡过程的转录复制复合体的关键状态,将其命名为cap(-1)’-RTC,解析其2.8埃的冷冻电镜结构(图2)。该复合体由E-RTC和单链结合蛋白nsp9共同组成,nsp9通过其N端氨基酸与聚合酶nsp12上的核苷转移酶(NiRAN)结构域结合,引导帽合成过程由第二步向第三步的过渡。随后,进一步证实聚合酶nsp12的NiRAN结构域负责催化帽结构合成的第二步酶学反应,回答了冠状病毒研究中近20年来悬而未决的问题,首次彻底明确了mRNA合成过程中全部的关键酶分子,为抗病毒药物研发提供了新的靶点。